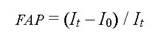Introducción
Según la base de datos de 2018 del Observatorio Global de Cáncer, Globocan, en ese año se presentaron en el planeta 18 millones de casos nuevos de cáncer y 9,5 millones de muertes por esta causa. Entre los principales cánceres para los seres humanos se encuentran los de mama, los colorrectales y los del hígado, que a nivel mundial ocupan las posiciones 1.º, 4.º y 7.º de la incidencia y 2.º, 3.º y 4.º de la mortalidad por neoplasias malignas [1]. El cáncer es un conglomerado de muchas enfermedades, con múltiples causas. La etiología del cáncer abarca diversidad de factores de riesgo, algunos de ellos atribuibles al comportamiento de los individuos y, por ende, son considerados como modificables, destacándose entre estos el fumar tabaco, el consumo nocivo de bebidas alcohólicas, el bajo consumo de frutas y verduras, el exceso de peso, la inactividad física y la exposición a radiación solar [2].
Para la Agencia Internacional de Investigación sobre el Cáncer (International Agency for Research on Cancer, iarc), el exceso de peso (medido con el índice de masa corporal (imc) ≥ 25 kg / m2) es un factor de riesgo común para los cánceres de hígado, colorrectal y de mama (en mujeres posmenopáusicas) [3]. En Colombia, el exceso de peso aumentó en todos los grupos etarios entre 2010 y 2015 [4]. La última Encuesta Nacional de la Situación Nutricional (ensin 2015) informó que las prevalencias de exceso de peso por grupos etarios son del orden del 6,3 % en menores de 5 años, el 24,4 % en escolares (5 a 12 años), el 17,9 % en adolescentes (13 a 17 años) y el 56,5 % en adultos (18 a 64 años). En estos últimos, el exceso es mayor en las mujeres, los afrodescendientes, en sujetos con índice de riqueza medio y en las regiones con menor desarrollo humano y estructural [4].
Para explicar la relación entre la obesidad y el riesgo de cáncer, se han propuesto tres vías principales, las cuales pueden superponerse:
-
La resistencia a la insulina / vía igf. Tanto la resistencia a la insulina, característica en las personas obesas, como la hiperinsulinemia se han asociado con niveles sanguíneos elevados de concentraciones libres del factor de crecimiento insulínico tipo 1 (insulin-like growth factor-1, igf-1) biodisponible. Los dos últimos posiblemente ejercen efectos antiapoptóticos y proliferativos celulares, que pueden promover el crecimiento tumoral. Esta vía parece ser en especial relevante para los cánceres colorrectal y de páncreas, y potencialmente, para el cáncer de próstata [5,6].
-
La vía inflamatoria. La inflamación subclínica crónica, estrechamente relacionada con la obesidad, se evidencia por concentraciones elevadas de citocinas proinflamatorias y proteínas de fase aguda, que incluyen el factor de necrosis tumoral-alfa (tumor necrosis factor-alpha, tnf-α), la interleucina-6 (il-6) y la proteína C reactiva (pcr). La inflamación es relevante en la progresión del tumor. Esta vía es particularmente importante para el cáncer colorrectal, cuyo riesgo es más alto en pacientes con enfermedad inflamatoria intestinal, en quienes se ha visto reducción del riesgo con el consumo de aspirina [5,6].
-
La vía de las hormonas sexuales. Tanto la síntesis reducida de progesterona ovárica, antes de la menopausia (ocasionada por el hiperandrogenismo ovárico, inducido por la obesidad), como los niveles más altos de estradiol biodisponible y testosterona, después de la menopausia (como efecto de la obesidad), posiblemente reducen la apoptosis y aumentan la proliferación celular, lo cual puede promover el desarrollo de tumores. Esta vía es particularmente relevante para los cánceres de mama y el endometrio [5].
Con el fin de estimar el impacto que a nivel poblacional podría ejercer la eliminación de la exposición a un factor causal sobre la carga de la enfermedad, internacionalmente se ha usado la medida epidemiológica conocida como fracción atribuible poblacional (fap), útil para orientar a los tomadores de decisiones en la planificación de intervenciones en salud pública [7-10]. Si bien existen, en la literatura científica, diversas definiciones de la fap, las siguientes llaman la atención por su simplicidad: “la proporción de la enfermedad en la población objetivo que no habría ocurrido en ausencia del factor”, que es similar a “la proporción de la ocurrencia de la enfermedad que potencialmente podría ser eliminada si la exposición al factor de riesgo fuera prevenida” [11], p. 1186.
Se estima que, en 2012, la fap de cáncer debida al imc alto en siete países seleccionados (cada uno representando una región del mundo) fue mayor en las mujeres, obteniéndose proporciones superiores para las regiones de Norteamérica (Estados Unidos, 9,5 %), el Medio Oriente (Arabia Saudita, 9,2 %), Suramérica (Argentina, 8,9 %) y Europa (Reino Unido, 8,2 %). Proporciones inferiores se reportaron para las regiones del este asiático (China, 3,0 %), África subsahariana (Ghana, 2,0 %) y el sur asiático (India, 1,2 %). En los hombres, los estimados de las fap oscilaron entre 4,5 % (Argentina) y 0,2 % (India) [12].
Desde la perspectiva computacional, el software Prevent -de acceso libre- ha sido utilizado, en algunos países europeos, en Australia y en Colombia, para la simulación dinámica de la incidencia futura de cáncer en general, o de cánceres específicos, o de los costos en salud, como efecto de la intervención hipotética de uno o varios factores de exposición, entre otros, el tabaquismo, el consumo de alcohol, el nivel educativo, el consumo de frutas y vegetales, la actividad física y el peso corporal [13-17]. En Colombia, la estimación de la fap de cáncer colorrectal, como medida del impacto potencial de la reducción teórica de la exposición a carnes procesadas y rojas, el tabaquismo, el consumo de alcohol, el exceso de peso y el estilo de vida sedentario, ya fue descrita [18,19].
El objetivo de este estudio fue estimar el impacto potencial de la disminución teórica del imc, sobre la incidencia y la fap de cánceres hepático, colorrectal y de mama, en el contexto colombiano, 2016-2050.
Metodología
Estudio de macrosimulación, bajo diferentes escenarios hipotéticos, de la disminución del imc como variable continua.
Para conocer el impacto de la intervención teórica del imc sobre la incidencia y la fap de tres cánceres seleccionados, se realizaron simulaciones basadas en los datos que se describen en las “entradas”, las cuales produjeron proyecciones de la incidencia de cada cáncer (salidas) en términos de números de casos nuevos y tasas específicas. Seguidamente, las “salidas” fueron utilizadas para el cálculo de la fap, que fue entendida en este estudio como la proporción de casos de cada cáncer que podría evitarse si toda la población colombiana tuviera el imc ideal.
Entradas para la simulación y fuentes de los datos
Para realizar la macrosimulación, fueron utilizados datos provenientes de diferentes fuentes oficiales, principalmente nacionales. La simulación utilizó como “entradas”, 1) datos de proyecciones de la población por edad y sexo; 2) patrones esperados y valores ideales del imc por sexo y edad; 3) escenarios hipotéticos de la disminución del imc; 4) estimados de la incidencia de cada cáncer por sexo y grupo de edad, y 5) funciones de riesgo para la relación entre el imc y el desarrollo de cada cáncer.
-
Proyecciones de población por edad y sexo. Se utilizaron las proyecciones nacionales de población por sexo y edades simples (de 0 a 80 años y más), efectuadas para el 2016 por el Departamento Administrativo Nacional de Estadística (dane) [20]. Además, fueron utilizadas las proyecciones de población por sexo y grupos etarios quinquenales (0 a 100 años y más), realizadas para el periodo 2017-2050 por la Comisión Económica para América Latina y el Caribe [21].
-
Patrones esperados y valores ideales del imc por sexo y edad. Los valores medios esperados del imc, con sus desviaciones estándar (de) por sexo y edades simples (de 0 a 75 años), fueron proyectados para cada año del periodo 2016-2050, a partir de ecuaciones de regresión lineal, construidas con datos reales del imc reportados por las ensin para los años 2005 y 2010 [22]. Los valores ideales del imc para niños y adolescentes según sexo y edades simples (de 0 a 17 años) se obtuvieron empleando modelos de regresión lineal basados en los patrones de crecimiento publicados por la Organización Mundial de la Salud en 2006 y en 2007, que fueron adoptados por Colombia en 2010 [23,24]. Para la población adulta (de 18 a 75 años), el valor ideal del imc (21,7 kg / m2) correspondió al promedio de los valores mínimo (18,5 kg / m2) y máximo (24,9 kg / m2) de la categoría “normal” del estado nutricional para sujetos entre 18 y 64 años; el valor ideal de la de fue de 1 kg / m2 [24,25].
-
Escenarios hipotéticos de la disminución del imc. Fueron considerados dos escenarios: el primero supuso la “Reducción acumulada del 10 % de la diferencia del índice de masa corporal”, por comparación de los valores medios esperados e ideales según sexo y edad simple, durante los primeros 10 años (2016-2026), y luego, manteniendo constante esta reducción hasta el 2050. El segundo escenario consideró “Toda la población con índice de masa corporal ideal” desde el año 2017 hasta el 2050.
-
Estimados de la incidencia de cáncer por sexo y grupo de edad. Se emplearon los estimados nacionales de la incidencia de cada cáncer (tasas crudas y ajustadas por edad -tae-) por sexo y grupos etarios quinquenales (de 0 a 70 años y más), publicados por el Instituto Nacional de Cancerología ese de Colombia para el período 2007-2011. La metodología utilizada se basó en los datos de incidencia reportados por los registros poblacionales de cáncer de las ciudades de Bucaramanga, Cali, Manizales y Pasto, además de los datos de mortalidad proporcionados por el dane [26].
-
Funciones de riesgo para la relación entre el imc y el desarrollo de cada cáncer. Se construyeron funciones de riesgo lineales para cada cáncer, utilizando medidas de asociación (riesgo relativo -rr- o Hazard Ratio -hr-) reportadas por grandes metaanálisis o estudios epidemiológicos con mayores niveles de evidencia [27-29].
La elección de la evidencia con mayor relevancia epidemiológica partió de una revisión narrativa, efectuada por una asistente de investigación entrenada en búsqueda de literatura científica en salud, bajo la supervisión del investigador principal del estudio.
La búsqueda se enfocó en artículos referentes a estudios epidemiológicos observacionales, revisiones sistemáticas o metaanálisis, que informaran medidas de asociación para la relación entre cada cáncer de interés y el estado nutricional, este último determinado con base en tres categorías del imc: normal, sobrepeso u obesidad. La búsqueda no se limitó por fecha de publicación ni por idioma, y se realizó en las bases de datos PubMed, medline, Cochrane de Revisiones Sistemáticas y en el buscador de Google.
De todos los artículos obtenidos, se revisaron los títulos y los resúmenes, y solo en aquellos que informaban medidas de asociación para cada cáncer y cada una de las tres categorías del imc, se dio lectura a los textos completos. La información de estos últimos fue resumida y registrada en instrumentos adaptados de los parámetros establecidos por las declaraciones strobe y prisma,1 según el tipo de estudio; y cuando se trató de revisiones sistemáticas, su calidad fue evaluada utilizando la herramienta Ameasurement Tool to Assess Systematic Reviews (amstar).
Finalmente, el grupo investigador seleccionó por consenso aquellos metaanálisis, revisiones sistemáticas o estudios con mayores niveles de evidencia y tamaños de la muestra, y de ser posible, con participación de población colombiana o latinoamericana.
El intercepto y la pendiente obtenidos en cada regresión lineal fueron los insumos ingresados al programa Prevent, para generar las simulaciones para cada cáncer (véase Tabla 1].
Tabla 1
Funciones de riesgo para cánceres colorrectal, hepático y de la mama, según nivel de exceso de peso y fuerza de la asociación.
Estudio de macrosimulación
Para proyectar la incidencia en Colombia de cánceres hepático, colorrectal y de mama, bajo distintos escenarios de distribución poblacional del imc por sexo y por edad en el periodo 2016-2050, se utilizó el software de simulación Prevent v3.01, ya empleado por otros estudios de simulación europeos.
Inicialmente, los datos correspondientes a las “entradas” para la simulación fueron consolidados en un archivo elaborado en el programa Access® 2007, conformado por hojas independientes, una por tipo de entrada, exceptuando los estimados de la incidencia de cáncer por sexo y grupo de edad, que se registraron en hojas separadas para cada cáncer seleccionado. Luego, en ese archivo se incluyó una hoja con las características generales de la simulación, en la cual se especificaron el horizonte de la proyección de 34 años (entre 2016 y 2050), el año cero (correspondiente al 2016), el factor de riesgo y las enfermedades a modelar. Además, se añadió otra hoja, en la que se registraron dos variables epidemiológicas de tiempo a incorporar en las simulaciones, siendo estas el “tiempo lat” (entendido como el tiempo transcurrido entre el momento en el que inicia la intervención sobre la exposición al factor de riesgo y el momento en el que aparece el efecto, sin que este periodo de cambio en la exposición se traduzca en un cambio notable en la incidencia -que en nuestro estudio tuvo una asignación de 3 años-) y el “tiempo lag” (correspondiente al periodo transcurrido desde el final del lat hasta la obtención del efecto total en términos del rr, que es lo mismo que el tiempo de duración del efecto de la intervención sobre el factor de riesgo -designado con valor de 20 años en nuestras simulaciones-) [13,19,30].
Prevent v3.01 leyó el archivo elaborado en Access® 2007 y generó simulaciones con las proyecciones de la incidencia esperada para cada cáncer según los escenarios propuestos. La descripción detallada de los cálculos matemáticos realizados por el software Prevent v3.01 está descrita en una publicación previa [13]. Cuando la intervención del factor de riesgo fue nula para el año cero (correspondiente al 2016), Prevent estimó la incidencia de cada cáncer en el escenario de “Referencia” “real” (modelos línea de base), soportado en la tendencia histórica de la distribución del imc por sexo y edad observada en Colombia [22]. Adicionalmente, Prevent proyectó la incidencia futura de cada cáncer basado en la disminución de la diferencia entre los valores medios del imc esperados e ideales según sexo y edad, es decir, según escenario de intervención del imc.
Las “salidas” de las simulaciones para cada cáncer correspondieron a: 1) números de casos incidentes (es decir, los casos esperados) y 2) tasas específicas por sexo y edad para cada uno de los tres escenarios propuestos, que posteriormente el equipo investigador convirtió a tae mediante el método directo para la estandarización de tasas (utilizando la distribución porcentual de la población mundial por grupos de edad, propuesta por Mitsuo Segi [31]), expresadas por 100 000 años-persona.
A partir de los números de casos incidentes proyectados para cada cáncer y escenario de simulación, el grupo investigador: 1) calculó diferencias entre la incidencia futura sin intervención del imc (escenario de “Referencia”) y la incidencia futura para cada escenario de intervención, las cuales correspondieron a los casos evitables; y 2) utilizó los casos incidentes proyectados para los escenarios de “Referencia” y de “Toda la población con índice de masa corporal ideal”, para calcular la fap, por medio de la aplicación de la fórmula 1 [7,9,32]:
(proporción de casos de cada cáncer que podría evitarse si toda la población colombiana tuviera el imc ideal).
Los cálculos efectuados por el equipo investigador fueron realizados con los programas informáticos: Prevent, autor: Jan Barendregt, Róterdam (Países Bajos), versión 3.01; Microsoft office - Access® 2007 y Microsoft office - Excel® 2010, licencia del Instituto Nacional de Cancerología ese.
Aspectos éticos
Este estudio se clasificó en la categoría de “Investigación sin riesgo”, según la Resolución 8430 de 1993 del Ministerio de Salud de Colombia [33]. El mismo fue aprobado por el Comité de Ética en Investigación del Instituto Nacional de Cancerología ese, mediante el Acta 20 del 7 de octubre de 2015, y recibió renovación anual del aval técnico-científico, según consta en las actas 25 del 27 de septiembre de 2017 y 40 del 31 de octubre de 2018.
Los datos obtenidos a partir de las fuentes de información mencionadas y que no eran de carácter público fueron manejados bajo estrictos criterios de confidencialidad.
Resultados
La comparación de los valores medios del imc obtenidos por la población colombiana en 2005 y 2010 [22] evidenció cambios ascendentes en ambos sexos y en la mayoría de los grupos de edad, particularmente notorios en el subgrupo de 28 a 32 años (hombres, 0,89 kg / m2, y mujeres, 0,77 kg / m2), en contraste con reducciones leves observadas en las mujeres de 5 a 17 años (-0,11 kg / m2), en los hombres de 43 a 49 años (hombres -0,03 kg / m2) y en el subgrupo de 50 a 64 años (mujeres -0,21 kg / m2 y hombres -0,05 kg / m2) (véase Tabla 2].
Tabla 2
Distribución del índice de masa corporal según sexo y edad, bajo el escenario de “Referencia”. Colombia, 2005-2050.
En 2010, la distribución de los valores medios del imc permitió identificar el predominio del sobrepeso (imc ≥ 25,0 kg / m2 a < 30,0 kg / m2) en los adultos de ambos sexos a partir de los 28 años, observándose los valores más altos en las mujeres de 50 a 64 años (27,82 kg / m2) y en los hombres de 38 a 42 años (26,22 kg / m2).
Desde la perspectiva del efecto, los estimados nacionales de la incidencia de cánceres hepático, colorrectal y de mama para el periodo 2007-2011, en hombres y mujeres de 15 años en adelante, correspondieron a: 1) totales de casos anuales: 541 y 597 cánceres hepáticos, 2401 y 2784 cánceres colorrectales, y 7627 cánceres de mama (solo mujeres); y 2) tae (por 100 000 habitantes) anuales: 2,8 y 2,6 para el cáncer hepático, 12,2 y 12,3 para el cáncer colorrectal, y 33,8 para el cáncer de mama (solo mujeres) [26].
Variación del imc en el escenario de “Referencia”. Para el periodo 2016-2050 se simularon variaciones ascendentes en los valores medios del imc, en ambos sexos y para la mayoría de los grupos etarios, excepto en los hombres de 43 años en adelante y en las mujeres de 5 a 17 años y de 50 a 75 años, en quienes se proyectó un comportamiento levemente descendente. Las variaciones decenales más altas correspondieron a los adultos de 28 a 32 años, con estimados de 1,76 kg / m2 en hombres y 1,55 kg / m2 en mujeres (véase Tabla 2].
Según nuestras simulaciones, en 2050 habrá en Colombia predominio del sobrepeso (imc ≥ 25,0 kg / m2 a < 30,0 kg / m2) en los hombres a partir de los 18 años, y en las mujeres, desde los 23 años, y aparición de la obesidad (≥ 30,0 kg / m2) en los adultos de ambos sexos de 28 a 32 años. En los menores de 5 años también se destacarán el sobrepeso en las niñas (imc ≥ 17,19 kg / m2 a < 19,12 kg / m2) y la obesidad en los niños (≥ 19,26 kg / m2) (véase Tabla 2].
Incidencia absoluta y tae (por 100 000 habitantes) de cánceres de mama, colorrectal y hepático, según escenario de simulación del imc, sexo y edad. Las proyecciones realizadas para el periodo 2016-2050 indican que la incidencia más alta de cada cáncer ocurrirá en el escenario de “Referencia”, en el siguiente orden decreciente: 404 444 cánceres de mama en mujeres, 274 637 cánceres colorrectales en ambos sexos (índice de masculinidad = 0,87) y 59 575 cánceres hepáticos en ambos sexos (índice de masculinidad = 0,92) (véase Tabla 3].
Tabla 3
Incidencia absoluta de cánceres de hígado, colorrectal y de la mama, proyectados según sexo y escenarios de simulación del índice de masa corporal. Colombia, 2016-2050.
Bajo el escenario de “Toda la población con índice de masa corporal ideal” desde 2017, se proyectó para el 2050 la incidencia absoluta de 11 470 cánceres de mama en mujeres, 8680 cánceres colorrectales en ambos sexos (índice de masculinidad = 0,86) y 1754 cánceres hepáticos en ambos sexos (índice de masculinidad = 1,02).
Según nuestras simulaciones, el grupo de edad de 70 años y más registrará, en ambos sexos, la incidencia absoluta más alta para los tres cánceres de interés, tanto en 2016 (línea de base) como en 2050 (final). Igualmente, para este mismo grupo de edad se proyectaron las reducciones de casos totales más sobresalientes bajo el escenario de “Toda la población con índice de masa corporal ideal” desde 2017, destacándose el impacto que ejercería esta intervención en la disminución del cáncer de mama en las mujeres con estas edades (véase Figura 1].
Figura 1
Casos esperados de cánceres de hígado, colorrectal y de la mama, según sexo, edad y escenarios de simulación del índice de masa corporal. Colombia, 2016-2050. a. Hombres; b. mujeres. ch: Cáncer hepático; ccr: Cáncer colorrectal; cm: Cáncer de mama; imc: Índice de masa corporal.
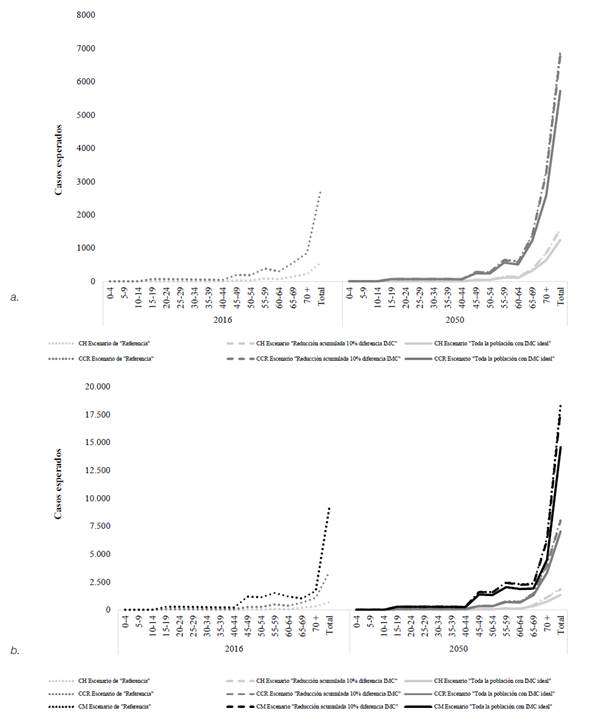
Respecto a las tae por 100 000 habitantes, proyectadas para cada cáncer bajo el escenario de “Referencia” entre 2016 y 2050, nuestras simulaciones arrojaron valores anuales constantes, correspondientes, en los hombres, a 12,2 para cáncer colorrectal y 2,5 para cáncer hepático, y en las mujeres, a 33,8 para cáncer de mama, 12,4 para cáncer colorrectal y 2,5 para cáncer hepático (véase Figura 2]
Figura 2
Variación anual de las tasas ajustadas por edad de cánceres (a) de la mama , (b) colorrectal y (c) del hígado, proyectadas según sexo y escenario de simulación del imc. Colombia, 2016-2050. tae: Tasas ajustadas por edad; imc: Índice de masa corporal. Las líneas verticales, punteadas, enmarcan los cambios presentados en el riesgo de desarrollar cáncer durante el tiempo lag de 20 años, en los tres escenarios de modelamiento (sin y con intervención del imc).
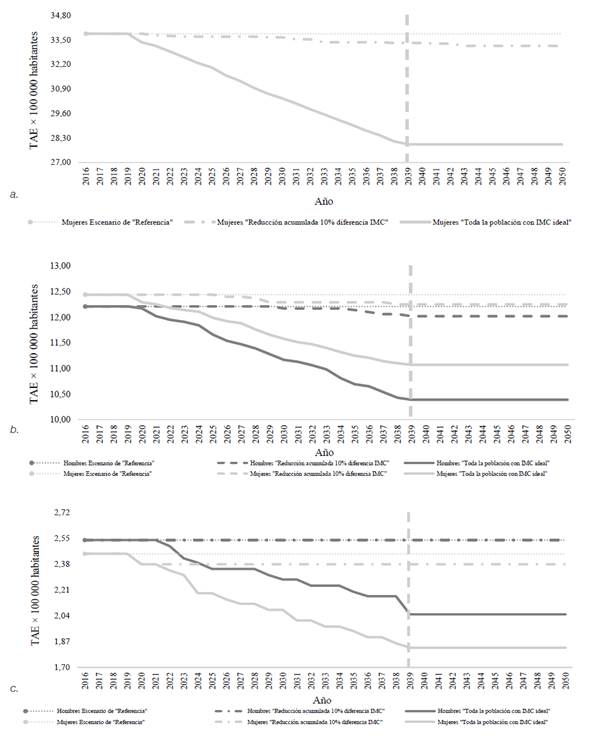
Las tae más bajas fueron simuladas en el escenario de “Toda la población con índice de masa corporal ideal” desde 2017 y obtenidas para el año 2039, con base en el tiempo lag (es decir, 20 años después de sucedido el tiempo lat de 3 años, contado este último entre 2016 y 2019), momento a partir del cual permanecieron estables hasta el año 2050. Estas fueron: para el cáncer de mama, 28,0; para el cáncer colorrectal, 10,4 en hombres y 11,1 en mujeres, y para el cáncer hepático, 2,1 en hombres y 1,8 en mujeres.
Valores absolutos y relativos de casos evitables de cánceres de mama, colorrectal y hepático, según sexo y escenario de simulación del imc. Nuestras simulaciones arrojaron los siguientes totales de casos evitables, bajo el escenario de “Reducción acumulada del 10 % de la diferencia del índice de masa corporal” entre 2016-2026, sostenida hasta 2050: 4009 cánceres de mama (en mujeres), 2086 cánceres colorrectales (1111 en hombres) y 728 cánceres hepáticos (440 en mujeres) (véase Tabla 4].
Tabla 4
Número de casos esperados y evitables de cánceres hepático, colorrectal y de la mama, según sexo y escenario de simulación del índice de masa corporal. Colombia, 2016-2050.
La mayor evitación se simuló bajo el escenario de “Toda la población con índice de masa corporal ideal” entre 2017 y 2050, obteniéndose valores máximos de 48 410 cánceres de mama (en mujeres), 25 089 cánceres colorrectales (13 303 en hombres) y 8648 cánceres hepáticos (5160 en mujeres).
Adicionalmente, los valores relativos de casos evitables proyectados bajo el escenario de “Reducción acumulada del 10 % de la diferencia del índice de masa corporal”, en las mujeres variaron entre 0,7 % (cáncer colorrectal) y 1,4 % (cáncer hepático), y en los hombres, entre 0,9 % (cáncer colorrectal) y 1,0 % (cáncer hepático) (véase Tabla 4).
fap de cánceres de mama, colorrectal y hepático, según sexo. La proporción simulada de cáncer que podría evitarse bajo el escenario de “Toda la población con índice de masa corporal ideal” entre 2017 y 2050 osciló, en las mujeres, entre 8,0 % (cáncer colorrectal) y 16,7 % (cáncer hepático), y en los hombres, entre 10,4 % (cáncer colorrectal) y 12,2 % (cáncer hepático) (véase Tabla 4].
Discusión
Los resultados de este estudio de simulación están soportados en distintos escenarios hipotéticos de cambios en el comportamiento del imc en la población colombiana, por sexo y edad para el periodo 2016-2050. En el escenario de “Referencia” -sustentado en datos primarios y estudios previos-, las variaciones de los valores medios por sexo y edad fueron principalmente ascendentes, alcanzando en 2050 cifras clasificables como “exceso de peso”, tanto en los menores de 5 años de ambos sexos como en los adultos hombres a partir de los 18 años, y en las mujeres, desde los 23 años. Este aspecto se consideró relevante, debido a que, en Colombia, la población adulta de 18 a 75 años es la que padece el total de la incidencia nacional de cáncer hepático y no menos del 97 % de la incidencia de cánceres de mama y colorrectal [26].
Al comparar los hallazgos de este trabajo contra los de un estudio realizado por la Non-communicable Disease Risk Factor Collaboration (ncd-RisC), que estimó la tendencia de los valores medios del imc en 200 países del mundo de 1975 a 2016, se encontró que los valores proyectados por nuestras simulaciones para los adultos colombianos de 18 a 64 años en 2016 (hombres, 25,5 kg / m2; mujeres, 26,3 kg / m2) eran superiores a los reportados para la población mundial mayor de 20 años en el mismo año (hombres, 24,5 kg / m2, ic 95 %: 24,3-24,6, y mujeres, 24,8 kg / m2,; ic 95 %: 24,6-25,0). No obstante, nuestros resultados fueron levemente inferiores a los informados por sexo para las regiones de Latinoamérica Central (incluida Colombia),2 del Sur, Andina y el Caribe [34]. Las discrepancias entre los hallazgos mencionados podrían explicarse, en parte, por diferencias en las distribuciones etarias que utilizaron ambos estudios, a la vez que por los distintos criterios aplicados para la inclusión de los datos (peso y estatura medidos en Colombia vs. datos medidos y autorreportados en algunos de los 2416 trabajos que integraron el gran estudio de la ncd-RisC).
Con respecto a las fracciones de cáncer que entre 2017 y 2050 podrían atribuirse, en la población colombiana, a la diferencia entre los valores medios esperados e ideales del imc por sexo y edad -y que, por lo tanto, son evitables al eliminar dicha diferencia-, nuestras simulaciones proyectaron, para las mujeres, valores de fap del orden de 16,7, 12,0 y 8,0 % para cánceres hepático, de mama y colorrectal, y para los hombres, de 12,2 y 10,4 % para cánceres hepático y colorrectal.
Comparativamente, las fap obtenidas en este estudio de simulación son más altas que las reportadas por el estudio de carga mundial de cáncer atribuible a diabetes e imc alto (por separado y en conjunto), que utilizó datos de 175 países obtenidos para el periodo 1980-2002, e informó valores de fap para el imc alto (≥ 25,0 kg / m2), en mujeres, de 13,5 % (ic 95 %: 7,8-19,4), 6,9 % (ic 95 %: 4,4-9,4) y 7,0 % (ic 95 %: 5,0-9,1) para cánceres hepático, de mama y colorrectal, y en hombres, de 10,1 % (ic 95 %: 5,7-14,7) y 5,8 % (ic 95 %: 4,2-7,4) para cánceres hepático y colorrectal [35]. Las diferencias identificadas entre los resultados de ambos estudios podrían deberse a una mayor prevalencia de exceso de peso en Colombia, o a una mayor incidencia de los cánceres mencionados también en nuestro país, o a la inclusión en nuestras simulaciones de rr probablemente más altos.
Desde la perspectiva teórica, se debe aclarar que ninguna intervención hipotética del exceso de peso podría reducir a “0” la incidencia de cualquiera de los cánceres de interés o elevar a 100 % las fap respectivas, por tratarse de enfermedades multicausales, en las que cobran importancia otros factores de riesgo para su generación, lo cual no fue abordado en esta investigación. Los mayores números de casos evitables bajo el escenario de “Toda la población con índice de masa corporal ideal” entre 2017 y 2050 correspondieron a 48 410 cánceres de mama en mujeres y a 25 089 cánceres colorrectales en ambos sexos, lo cual se explica por la alta incidencia de estas enfermedades bajo el escenario de “Referencia”. Se considera que estos resultados son relevantes para el control del cáncer en el ámbito nacional, debido a que, en Colombia, el cáncer de mama ocupa el primer lugar de la incidencia de cáncer en mujeres (tae por 100 000 habitantes: 33,8), a la vez que el cáncer colorrectal, el tercer lugar en mujeres (12,3) y el cuarto en hombres (12,2) [26].
El incremento del imc en la población colombiana entre 2010 y 2015 [4] y, por ende, lo proyectado en esta simulación matemática concuerdan con los principales impulsores de la epidemia de obesidad a nivel mundial: la globalización de los sistemas alimentarios, que promueven la producción, comercialización y sobreingesta pasiva de productos alimenticios más procesados -muchos de ellos hipercalóricos y de pobre valor nutricional-, y la urbanización y la disminución de la actividad física, consecuencia de la modernización de los estilos de vida [35-38]. Aunque, en Colombia, la obesidad fue definida como una prioridad de salud pública desde 2009 [39], en nuestro territorio aún no se han implementado todas las recomendaciones propuestas por la Organización Panamericana de la Salud para prevenir esta enfermedad, entre ellas, las referentes a la “restricción de la comercialización de alimentos y bebidas malsanos a los niños”, la reglamentación del suministro o venta de alimentos en el entorno escolar y el establecimiento de “políticas impositivas para limitar el consumo de alimentos malsanos”, estos últimos correspondientes a productos procesados y ultraprocesados, que contienen cantidades elevadas de sodio, azúcares libres, grasas totales, grasas saturadas y ácidos grasos trans [40].
Paradójicamente, cabe resaltar que Colombia se encuentra experimentando una transición alimentaria: en el periodo 2010-2015, evidenció, tanto en niños como en adultos, una tendencia a la disminución en el consumo de pan, tubérculos, azúcar, alimentos fritos y alimentos light -lo cual podría interpretarse como una tendencia hacia la “dieta saludable”-, pero también hacia la reducción en la ingesta de leche, carne, atún, vísceras (no compensada por el aumento leve en la frecuencia / día del consumo de huevos, pollo o gallina), al igual que de frutas, lo cual ha sido explicado hipotéticamente como un asunto de desigualdades e inequidades sociales, que ha llevado a la reducción en el gasto de alimentos (siendo los proteicos los más costosos) en los estratos socioeconómicos medio y bajo [41].
Este estudio reconoce como sus principales limitaciones: 1) el haber realizado todas las simulaciones asumiendo un comportamiento lineal del imc (que se proyectó para Colombia en el periodo 2016-2050, a partir de datos reales disponibles para los años 2005 y 2010) y el haber usado funciones lineales para establecer la relación entre el aumento por unidad de imc y el riesgo para cada cáncer de interés (por requerimiento del software Prevent), esto último considerando que un estudio similar efectuado en Brasil utilizó una función log-logit “para representar cada valor de rr en unidades de imc” [42]; 2) el haber utilizado medidas de asociación (rr o hr) reportadas por grandes metaanálisis de estudios observacionales efectuados principalmente en países desarrollados [27-29], cuya magnitud del efecto podría ser diferente para Colombia y por subgrupos de población; 3) el haber incluido tiempos lat de 3 años y lag de 20 años, iguales o similares a los empleados en otros estudios de simulación europeos que también usaron el software Prevent, pero con distintos factores de riesgo [13,18], esto debido a la carencia de información sobre el periodo de latencia que debe transcurrir entre la determinación del imc alto y la incidencia de cáncer en cualquier contexto; no obstante, recientemente identificamos varios estudios que asignaron a dicho periodo de latencia un valor de 10 años [25,35,42], uno de los cuales sugirió que este podría ser diferente según el nivel de imc [42] ; y 4) el considerar que las proyecciones obtenidas por el presente estudio son posibles en un mundo en el que los cambios del imc son predecibles en el tiempo, sin tomar en cuenta la evolución de los patrones de la dieta a escala global.
Conclusión
Intervenir para disminuir el exceso de peso (imc ≥ 25,0 kg / m2) en la población colombiana contribuiría especialmente a reducir el riesgo de cáncer hepático en ambos sexos y el número de casos de cáncer de mama (en mujeres). Para ello, se requiere del compromiso y la participación activa del Estado, de todos los sectores económicos, la sociedad civil y los medios de comunicación, en la realización de acciones multinivel que promuevan y sustenten la alimentación saludable y el aumento de la actividad física regular y adecuada en el ámbito nacional.