Síndrome de Down mosaico y leucemia linfoblástica aguda de células B: reporte de un caso
DOI:
https://doi.org/10.17533/udea.iatreia.v29n4a12Palabras clave:
leucemia linfoblástica aguda, mosaico, síndrome de down, trisomía 21Resumen
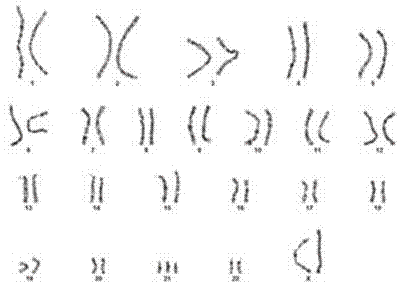
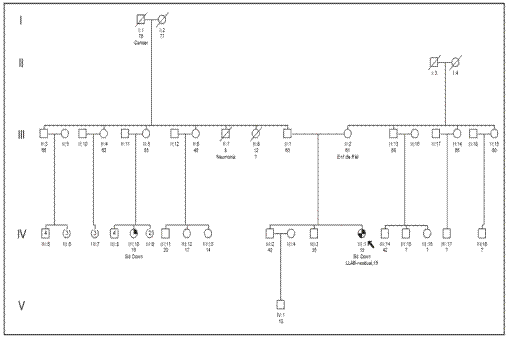
El síndrome de Down (SD) o trisomía 21 es una anomalía cromosómica constitucional, que puede presentarse en forma de mosaico en 1 % a 4 % de los casos. El diagnóstico de SD mosaico es difícil debido a que la mayoría de los pacientes tienen un fenotipo normal y no manifiestan alteraciones clínicas importantes. Los pacientes con SD tienen mayor riesgo de desarrollar leucemias agudas como la leucemia linfoblástica aguda (LLA). Presentamos el caso de una mujer de 19 años con trisomía 21 en mosaico y LLA de células B.
Descargas
Citas
(1.) Centers for diseases Control and Prevention [Internet]. Atlanta: NCBDDD; 2014 [Cited 2015 Nov 11]. Birth defects. Available from: http://www.cdc.gov/ncbddd/birthdefects/downsyndrome/data.html
(2.) Tejada MI. Retraso mental de origen genético. Presentación de la Red GIRMOGEN. Rev Neurol [Internet]. 2006 [consultado 2015 Nov 11];42(Supl 1):[S1-S6]. Disponible en: http://www.publicacions.ub.es/refs/Articles/retardmental.pdf
(3.) Weijerman ME, van Furth AM, Vonk Noordegraaf A, van Wouwe JP, Broers CJM, Gemke R. Epidemiología del síndrome de Down. Prevalencia, características neonatales y mortalidad durante el primer año del síndrome de Down: Un estudio nacional. J Pediatrics [Internet]. 2008 Mar [consultado 2015 Nov 11];152(1):[15-19]. Disponible en: http://www.down21.org/web_n/index.php?option=com_content&view=article&id=1645%3Aepidemiologia-del-sindromede-down&catid=440%3Aresumen-&Itemid=169
(4.) Papavassiliou P, Charalsawadi C, Rafferty K, Jackson-Cook C. Mosaicism for trisomy 21: a review. Am J Med Genet A. 2015 Jan;167A(1):26-39. DOI 10.1002/ajmg.a.36861.
(5.) Kaminker P, Armando R. Síndrome de Down. Primera parte: enfoque clínico-genético. Arch Argent Pediatr [Internet]. 2008 May-Jun [consultado 2015 Nov 11];106(3):[249-59]. Disponible en: http://www.scielo.org.ar/scielo.php?pid=S0325-00752008000300011&script=sci_arttext
(6.) University of Chicago Medicine [Internet]. Chicago: The University of Chicago Medical Center; 2015 [Cited 2015 Nov 12]. Mosaic Down Syndrome. Available from: http://www.uchicagokidshospital.org/onlinelibrary/content=s05240
(7.) Secretaría de Salud. Centro Nacional de Equidad de Género y Salud Reproductiva: Atención Integral de la Persona con síndrome de Down. Lineamiento Técnico [Internet]. México, D.F.: Secretaría de Salud; 2007 [Cited 2015 Nov 12]. Disponible en: http://www.salud.gob.mx/unidades/cdi/documentos/Sindrome_Down_lin_2007.pdf
(8.) González-Herrera L, Pinto-Escalante D, Ceballos-Quintal JM. Prevalencia de mosaicos en 100 individuos con diagnóstico de Síndrome de Down. Rev Biomed [Internet]. 1998 [consultado 2015 Nov 11];9(1):[214-22]. Disponible en: http://www.cirbiomedicas.uady.mx/revbiomed/pdf/rb98943.pdf
(9.) Garduño-Zarazúa LM, Giammatteo Alois L, Kofman-Epstein S, Cervantes Peredo AB. Prevalencia de mosaicismo para la trisomía 21 y análisis de las variantes citogenéticas en pacientes con diagnóstico de síndrome de Down. Revisión de 24 años (1986-2010) del Servicio de Genética del Hospital General de México ‘’Dr. Eduardo Liceaga”. Bol Med Hosp Infant Mex [Internet]. 2013 Ene-Feb [consultado 2015 Nov 11];70(1):[31-6]. Disponible en: http://www.scielo.org.mx/scielo.php?pid=S1665-11462013000100007&script=sci_arttext&tlng=en
(10.) Astete C, Youlton R, Castillo S, Be C, Daher V. Análisis clínico y citogenético en 257 casos de síndrome de Down. Rev Chil Pediatr [Internet]. 1991 [consultado 2015 Nov 11];62(2):[99-102]. Disponible en: http://www.scielo.cl/pdf/rcp/v62n2/art03.pdf
(11.) Avet-Loiseau H, Mechinaud F, Harousseau JL. Clonal hematologic disorders in Down syndrome. A review. J Pediatr Hematol Oncol. 1995 Feb;17(1):19-24.
(12.) Bathia S, Neglia JP. Epidemiology of childhood acute myelogenous leukemia. J Pediatr Hematol Oncol. 1995;17(2):94-100.
(13. Zipursky A, Poon A, Doyle J. Leukemia in Down syndrome: a review. Pediatr Hematol Oncol. 1992 Apr-Jun;9(2):139-49.
(14.) Dirección General de Epidemiología. La carga de las leucemias en el Perú. Bol Epidemiol [Internet]. 2014 Ago [consultado 2015 Nov 11];23(32):[630-49]. Disponible en: http://www.dge.gob.pe/portal/docs/vigilancia/boletines/2014/32.pdf
(15.) Crombet Ramos O, Svarch Guerchicoff E. Alteraciones hematológicas en el síndrome de Down. Rev Cubana Hematol Inmunol Hemoter [Internet]. 1998 [consultado 2015 Nov 11];14(2):[80-6]. Disponible en: http://bvs.sld.cu/revistas/hih/vol14_2_98/hih02298.htm
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2016 Iatreia

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Los artículos publicados en la revista están disponibles para ser utilizados bajo la licencia Creative Commons, específicamente son de Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional.
Los trabajos enviados deben ser inéditos y suministrados exclusivamente a la Revista; se exige al autor que envía sus contribuciones presentar los formatos: presentación de artículo y responsabilidad de autoría completamente diligenciados.