Tratamiento del papiloma oncocítico nasosinusal avanzado sin malignización asociada, con resección endoscópica y radioterapia en arcos de volumen modulado (RAVM). Reporte de un caso
DOI:
https://doi.org/10.17533/udea.iatreia.v30n4a09Palabras clave:
cavidad nasal, papiloma oncocítico, radioterapiaResumen
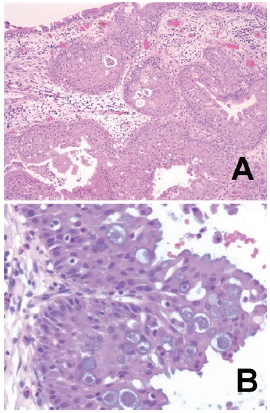
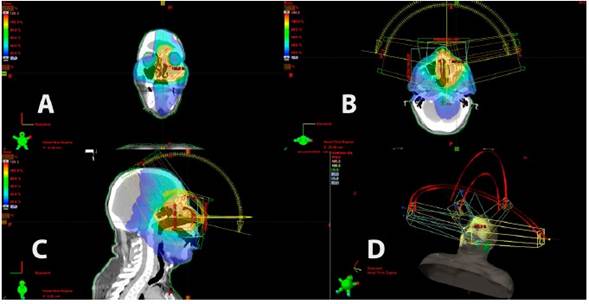
El papiloma oncocítico (PO) es una neoplasia rara de la cavidad nasal y los senos paranasales y es el subtipo histológico menos frecuente del papiloma rinosinusal. Al igual que el papiloma invertido (PI), se lo considera un tumor benigno, pero su comportamiento biológico no lo es tanto por su crecimiento local agresivo, su tasa alta de recurrencia y el riesgo de transformación maligna con asociación a carcinoma. El tratamiento de elección es la resección endoscópica. Se ha usado exitosamente la radioterapia para el tratamiento de los PI extensos, pero no se conocen informes documentados de su uso en pacientes con PO avanzado o con extensión extrasinusal y sin malignización asociada. Se presenta un caso de PO unilateral izquierdo con enfermedad extensa que comprometía la pared nasal lateral y los senos maxilar, etmoidal y frontal del mismo lado, tratado con radioterapia en arcos de volumen modulado.
Descargas
Citas
(1.) Hyams VJ. Papillomas of the nasal cavity and paranasal sinuses. A clinicopathological study of 315 cases. Ann Otol Rhinol Laryngol. 1971 Apr;80(2):192-206.
(2.) Kaufman MR, Brandwein MS, Lawson W. Sinonasal papillomas: clinicopathologic review of 40 patients with inverted and oncocytic schneiderian papillomas. Laryngoscope. 2002 Aug;112(8 Pt 1):1372-7.
(3.) Yang YJ, Abraham JL. Undifferentiated carcinoma arising in oncocytic Schneiderian (cylindrical cell) papilloma. J Oral Maxillofac Surg. 1997 Mar;55(3):289-94.
(4.) Liu CY, Tsai TL, Hsu CY, Lin CZ. Oncocytic Schneiderian papilloma. J Chin Med Assoc. 2004 May;67(5):255-7.
(5.) Barnes L, Bedetti C. Oncocytic Schneiderian papilloma: a reappraisal of cylindrical cell papilloma of the sinonasal tract. Hum Pathol. 1984 Apr;15(4):344-51.
(6.) Yaprak N, Aşık M, Turhan M, Toru H. Özbudak İH, Oncocytic Schneiderian Papilloma. Akd Med J. 2015;2:113-6.
(7.) Maitra A, Baskin LB, Lee EL. Malignancies arising in oncocytic schneiderian papillomas: a report of 2 cases and review of the literature. Arch Pathol Lab Med. 2001 Oct;125(10):1365-7.
(8.) Karligkiotis A, Bignami M, Terranova P, Gallo S, Meloni F, Padoan G, et al. Oncocytic Schneiderian papillomas: Clinical behavior and outcomes of the endoscopic endonasal approach in 33 cases. Head Neck. 2014 May;36(5):624-30. DOI 10.1002/hed.23341.
(9.) Cheng TY, Ueng SH, Chen YL, Chang KP, Chen TM. Oncocytic schneiderian papilloma found in a recurrent chronic paranasal sinusitis. Chang Gung Med J. 2006 May-Jun;29(3):336-41.
(10.) Suh KW, Facer GW, Devine KD, Weiland LH, Zujko RD. Inverting papilloma of the nose and paranasal sinuses. Laryngoscope. 1977 Jan;87(1):35-46.
(11.) Levendag PC, Annyas AA, Escajadillo JR, Elema JD. Radiotherapy for inverted papilloma: a case report. Radiother Oncol. 1984 Jun;2(1):13-7.
(12.) Hug EB, Wang CC, Montgomery WW, Goodman ML. Management of inverted papilloma of the nasal cavity and paranasal sinuses: importance of radiation therapy. Int J Radiat Oncol Biol Phys. 1993 Apr;26(1):67-72.
(13.) Wright EJ, Chernichenko N, Ocal E, Moliterno J, Bulsara KR, Judson BL. Benign inverted papilloma with intracranial extension: prognostic factors and outcomes. Skull Base Rep. 2011 Nov;1(2):145-50. DOI 10.1055/s-0031-1287687.
(14.) Guedea F, Mendenhall WM, Parsons JT, Million RR. The role of radiation therapy in inverted papilloma of the nasal cavity and paranasal sinuses. Int J Radiat Oncol Biol Phys. 1991 Apr;20(4):777-80.
(15.) Gomez JA, Mendenhall WM, Tannehill SP, Stringer SP, Cassisi NJ. Radiation therapy in inverted papillomas of the nasal cavity and paranasal sinuses. Am J Otolaryngol. 2000 May-Jun;21(3):174-8.
(16.) Rutenberg M, Kirwan J, Morris CG, Werning JW, Mendenhall WM. Radiation therapy for sinonasal inverted papilloma. Pract Radiat Oncol. 2013 Oct-Dec;3(4):275-81. DOI 10.1016/j.prro.2012.07.007.
(17.) Otto K. Volumetric modulated arc therapy: IMRT in a single gantry arc. Med Phys. 2008 Jan;35(1):310-7.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2017 Iatreia

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Los artículos publicados en la revista están disponibles para ser utilizados bajo la licencia Creative Commons, específicamente son de Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional.
Los trabajos enviados deben ser inéditos y suministrados exclusivamente a la Revista; se exige al autor que envía sus contribuciones presentar los formatos: presentación de artículo y responsabilidad de autoría completamente diligenciados.