Supresión del eje hipotálamo-hipófisis-suprarrenal después de la quimioterapia de inducción en niños con leucemia linfoide aguda
DOI:
https://doi.org/10.17533/udea.iatreia.v29n1a02Palabras clave:
ACTH, insuficiencia suprarrenal, leucemia linfoide aguda, niñosResumen
Introducción: se ha informado insuficiencia suprarrenal (IS) en 46 % a 81,5 % de los niños con leucemia linfoide aguda (LLA) que reciben esteroides durante la quimioterapia.
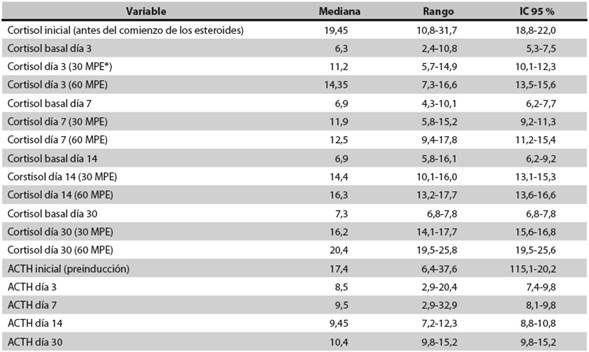
Materiales y métodos: para evaluar la frecuencia de dicha IS se hizo un estudio prospectivo de 40 pacientes menores de 18 años (media: 8,5 años) con diagnóstico nuevo de LLA. Se les midieron el cortisol basal y la adrenocorticotropina (ACTH). Todos recibieron prednisolona (60 mg/m2/día) durante 5 semanas; tres días después de suspendidos los esteroides se hizo una prueba de estimulación con 1 μg de ACTH. En los que tenían el cortisol anormal (<18 μg/dL) se hicieron pruebas de estimulación con ACTH en los días 7, 14 y 30 hasta que se normalizó el cortisol (>18 μg/dL).
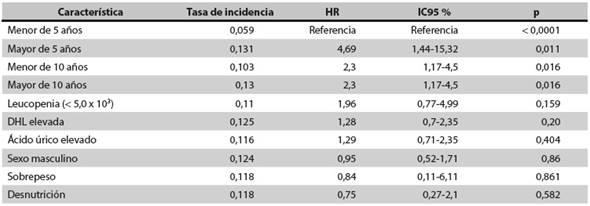
Resultados: en 29 de los 40 pacientes (72,5 %) se halló IS después del primer estímulo con ACTH, pero al día 30 en todos se había normalizado el nivel de cortisol. Todos los pacientes con IS fueron mayores de 5 años (HR: 4,69; IC95 %: 1,44-15,32; p = 0,011).
Conclusiones: los esteroides empleados durante el tratamiento de la LLA pueden causar IS, y el riesgo es más alto en los niños mayores de 5 años. Se sugiere hacer seguimiento durante los episodios de estrés porque es posible que requieran suplencia con esteroides.
Descargas
Citas
(1.) Surveillance, Epidemiology, and End Results Program [Internet]. Rockville: Surveillance Research Program, NCI; 1999 [cited 2012 Dec 8]. Ries LA, Kosary CL, Hankey BF, Miller BA, Clegg L, Edwards BK, editors. SEER Cancer Statistics Review, 1973-1996. Available from: http://seer.cancer.gov/archive/csr/1973_1996/
(2.) Howard SC, Metzger ML, Wilimas JA, Quintana Y, Pui CH, Robinson LL, et al. Childhood cancer epidemiology in low income countries. Cancer. 2008 Feb;112(3): 461-72.
(3.) Steinherz PG, Gaynon PS, Breneman JC, Cherlow JM, Grossman NJ, Kersey JH, et al. Cytoreduction and prognosis in acute lymphoblastic leukemia the importance of early marrow response: report from the Childrens Cancer Group. J Clin Oncol. 1996 Feb;14(2):389-98.
(4.) Schrappe M, Reiter A, Ludwig WD, Harbott J, Zimmermann M, Hiddemann W, et al. Improved outcome in childhood acute lymphoblastic leukemia despite reduced use of anthracyclines and cranial radiotherapy: results of trial ALL-BFM 90. German-Austrian-Swiss ALLBFM Study Group. Blood. 2000 Jun;95(11):3310-22.
(5.) Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004 Apr;350(15):1535-48.
(6.) Manabe A, Ohara A, Hasegawa D, Koh K, Saito T, Kiyokawa N, et al. Significance of the complete clearance of peripheral blasts after 7 days of prednisolone treatment in children with acute lymphoblastic leukemia: the Tokyo Children’s Cancer Study Group Study L 99-15. Haematologica. 2008 Aug;93(8):1155-60. DOI 10.3324/haematol.12365.
(7.) Aricò M, Basso G, Mandelli F, Rizzari C, Colella R, Barisone E, et al. Good steroid response in vivo predicts a favorable outcome in children with T-cell acute lymphoblastic leukemia. The Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP). Cancer. 1995 Apr;75(7):1684-93.
(8.) Möricke A, Zimmermann M, Reiter A, Henze G, Schrauder A, Gadner H, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia. 2010 Feb;24(2):265-84. DOI 10.1038/leu.2009.257.
(9.) Kato GJ, Quddus FF, Shuster JJ, Boyett J, Pullen JD, Borowitz MJ, et al. High glucocorticoid receptor content of leukemic blasts is a favorable prognostic factor in childhood acute lymphoblastic leukemia. Blood. 1993 Oct;82(8):2304-9.
(10.) Pui CH, Dahl GV, Rivera G, Murphy SB, Costlow ME. The relationship of blast cell glucocorticoid receptor levels to response to single-agent steroid trial and remission response in children with acute lymphoblastic leukemia. Leuk Res. 1984;8(4):579-85.
(11.) de Weerth C, Zijl RH, Buitelaar JK. Development of cortisol circadian rhythm in infancy. Early Hum Dev. 2003 Aug;73(1-2):39-52.
(12.) Shulman DI, Palmert MR, Kemp SF; Lawson Wilkins Drug and Therapeutics Committee. Adrenal insufficiency: still a cause of morbidity and death in childhood. Pediatrics. 2007 Feb;119(2):e484-94.
(13.) Einaudi S, Bertorello N, Masera N, Farinasso L, Barisone E, Rizzari C, et al. Adrenal axis function after high-dose steroid therapy for childhood acute lymphoblastic leukemia. Pediatr Blood Cancer. 2008 Mar;50(3):537-41.
(14.) Rix M, Birkebaek NH, Rosthøj S, Clausen N. Clinical impact of corticosteroid-induced adrenal suppression during treatment for acute lymphoblastic leukemia in children: a prospective observational study using the low-dose adrenocorticotropin test. J Pediatr. 2005 Nov;147(5):645-50.
(15.) Mahachoklertwattana P, Vilaiyuk S, Hongeng S, Okascharoen C. Suppression of adrenal function in children with acute lymphoblastic leukemia following induction therapy with corticosteroid and other cytotoxic agents. J Pediatr. 2004 Jun;144(6):736-40.
(16.) Dorin RI, Qualls CR, Crapo LM. Diagnosis of adrenal insufficiency. Ann Intern Med. 2003 Aug;139(3):194-204. Erratum in: Ann Intern Med. 2004 Feb;140(4):315.
(17.) Schmidt IL, Lahner H, Mann K, Petersenn S. Diagnosis of adrenal insufficiency: Evaluation of the corticotropin-releasing hormone test and Basal serum cortisol in comparison to the insulin tolerance test in patients with hypothalamic-pituitary-adrenal disease. J Clin Endocrinol Metab. 2003 Sep;88(9):4193-8.
(18.) Silva IN, Cunha CF, Finch FL, Colosimo EA. [Evaluation of hypothalamic-pituitary-adrenal axis recovery after corticotherapy by using basal cortisol secretion]. Arq Bras Endocrinol Metabol. 2006 Feb;50(1):118-24. Portuguese.
(19.) Pichler H, Reismüller B, Steiner M, Dworzak MN, Pötschger U, Urban C, et al. The inferior prognosis of adolescents with acute lymphoblastic leukaemia (ALL) is caused by a higher rate of treatment-related mortality and not an increased relapse rate – a population- based analysis of 25 years of the Austrian ALL-BFM (Berlin-Frankfurt-Mu€nster) Study Group. Brit J Haemato. 2013 May;161(4):556-65. DOI 10.1111/bjh.12292.
(20.) Bélien-Pallet V, Cabrol S, Fasola S, Petit A, Landman-Parker J, Auvrignon A, et al. [Is there a risk of steroid-induced adrenal deficit after induction treatment of acute lymphoblastic leukemia?]. Arch Pediatr. 2010 Dec;17(12):1637-44. DOI 10.1016/j.arcped.2010.09.001. French.
(21.) Liu D, Ahmet A, Ward L, Krishnamoorthy P, Mandelcorn ED, Leigh R, et al. A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy. Allergy Asthma Clin Immunol. 2013 Aug;9(1):30. DOI 10.1186/1710-1492-9-30.
(22.) Petersen KB, Müller J, Rasmussen M, Schmiegelow K. Impaired adrenal function after glucocorticoid therapy in children with acute lymphoblastic leukemia. Med Pediatr Oncol. 2003 Aug;41(2):110-4.
(23.) Vestergaard TR, Juul A, Lausten-Thomsen U, Lausen B, Hjalgrim H, Kvist TK, et al. Duration of adrenal insufficiency during treatment for childhood acute lymphoblastic leukemia. J Pediatr Hematol Oncol. 2011 Aug;33(6):442-9. DOI 10.1097/MPH.0b013e3182260cbe.
(24.) Gordijn MS, Gemke RJ, van Dalen EC, Rotteveel J, Kaspers GJ. Hypothalamic-pituitary-adrenal (HPA) axis suppression after treatment with glucocorticoid therapy for childhood acute lymphoblastic leukaemia. Cochrane Database Syst Rev. 2012 May 16;5:CD008727. DOI 10.1002/14651858.CD008727.pub2.
(25.) Kuperman H, Damiani D, Chrousos GP, Dichtchekenian V, Manna TD, Filho VO, et al. Evaluation of the hypothalamic-pituitary-adrenal axis in children with leukemia before and after 6 weeks of high-dose glucocorticoid therapy. J Clin Endocrinol Metab. 2001 Jul;86(7):2993-6.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2015 Iatreia

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Los artículos publicados en la revista están disponibles para ser utilizados bajo la licencia Creative Commons, específicamente son de Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional.
Los trabajos enviados deben ser inéditos y suministrados exclusivamente a la Revista; se exige al autor que envía sus contribuciones presentar los formatos: presentación de artículo y responsabilidad de autoría completamente diligenciados.