Anomalías de las arterias coronarias
DOI:
https://doi.org/10.17533/udea.iatreia.v29n1a9Palabras clave:
anomalías congénitas, circulación coronaria, enfermedad coronariaResumen
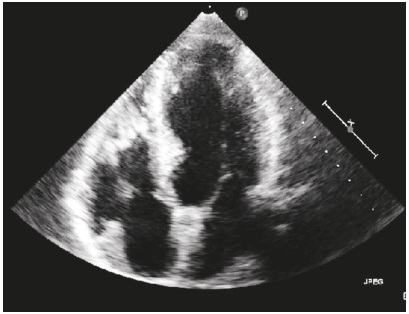
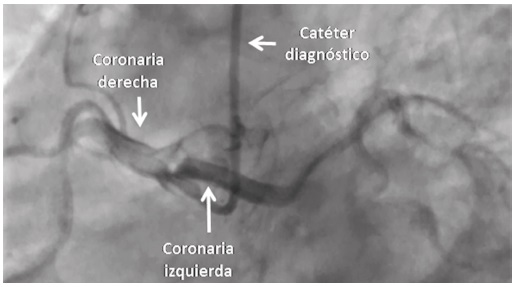
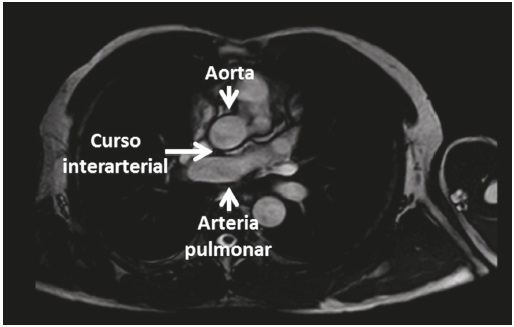
El dolor torácico no relacionado con trauma es una causa importante de consulta en los servicios de urgencias, con frecuencia alrededor del 10%, y es secundario al síndrome coronario agudo. La mayoría de las veces está relacionado con la formación de un trombo por ulceración o ruptura de una placa aterosclerótica. En algunos casos es secundario a causas raras como las anomalías del origen de las arterias coronarias. Presentamos el caso de un paciente con origen anómalo del tronco de la arteria coronaria izquierda, que ingresó con cuadro clínico sugestivo de síndrome coronario agudo sin elevación del segmento ST. Se discuten sus principales aspectos, el significado clínico y las opciones terapéuticas.
Descargas
Citas
(1.) Foy AJ, Filippone L. Chest pain evaluation in the emergency department. Med Clin North Am. 2015 Jul;99(4):835-47. DOI 10.1016/j.mcna.2015.02.010.
(2.) Lindsell CJ, Anantharaman V, Diercks D, Ho Han J, Hoekstra JW, Hollnmader JE, et al. The Internet Tracking Registry of Acute Coronary Syndromes (i*trACS): a multicenter registry of patients with of acute coronary syndromes reported using the standardized reporting guidelines for emergency department chest pain studies. Ann Emerg Med. 2006 Dec;48(6):666-77.e9. DOI 10.1016/j.annemergmed.2006.08.005.
(3.) Mendoza F. Dolor torácico en el servicio de urgencias: un reto por enfrentar. Rev Col Cardiol 2003 Sep-Oct;10(8):455-64.
(4.) Swap CJ, Nagurney JT. Value and limitations of chest pain history in the evaluation of patients with suspected acute coronary syndromes. JAMA. 2005 Nov;294(20):2623-9. Erratum in: JAMA. 2006 May;295(19):2250.
(5.) Graidis C, Dimitriadis D, Karasavvidis V, Dimitriadis G, Argyropoulou E, Economou F, et al. Percutaneous treatment of spontaneous left main coronary artery dissection using drug-eluting stent. BMC Cardiovasc Disord. 2014 Dec;14:191. DOI 10.1186/1471-2261-14-191.
(6.) Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, et al. Third universal definition of myocardial infarction. Circulation. 2012 Oct;126(16):2020-35. DOI 10.1161/CIR.0b013e31826e1058.
(7.) Ogden JA. Congenital anomalies of the coronary arteries. Am J Cardiol. 1970 Apr;25(4):474-9.
(8.) Angelini P, Villason S, Chan AV, Diez JG. Normal and Anomalous Coronary Arteries in Humans. In: Angelini P, Fairchild VD, editors. Coronary Artery Anomalies: A Comprehensive Approach. Philadelphia, PA: Lippincott Williams & Wilkins; 1999. p. 27-79.
(9.) Barriales-Villa R, Morís de la Tassa C. Anomalías congénitas de las arterias coronarias con origen en el seno de Valsalva contralateral: ¿qué actitud se debe seguir? Rev Esp Cardiol. 2006 Apr;59(4):360-70.
(10.) Yamanaka O, Hobbs RE. Coronary artery anomalies in 126,595 patients undergoing coronary arteriography. Cathet Cardiovasc Diagn. 1990 Sep;21(1):28-40.
(11.) Angelini P. Coronary artery anomalies: an entity in search of an identity. Circulation. 2007 Mar;115(10):1296-305.
(12.) Shriki JE, Shinbane JS, Rashid MA, Hindoyan A, Withey JG, DeFrance A, et al. Identifying, characterizing, and classifying congenital anomalies of the coronary arteries. Radiographics. 2012 Mar-Apr;32(2):453-68. DOI 10.1148/rg.322115097.
(13.) Kragel AH, Roberts WC. Anomalous origin of either the right or left main coronary artery from the aorta with subsequent coursing between aorta and pulmonary trunk: analysis of 32 necropsy cases. Am J Cardiol. 1988 Oct;62(10 Pt 1):771-7.
(14.) Angelini P, Monge G. Coronary Artery Anomalies. In: Moscucci M, editor. Grossman & Baim’s Cardiac Catheterization, Angiography, and Intervention, 8th ed. Philadelphia: LWW; 2014. p. 335-53.
(15.) Hauser M. Congenital anomalies of the coronary arteries. Heart. 2005 Sep;91(9):1240-5. DOI 10.1136/hrt.2004.057299.
(16.) Angelini P. Coronary artery anomalies--current clinical issues: definitions, classification, incidence, clinical relevance, and treatment guidelines. Tex Heart Inst J. 2002;29(4):271-8.
(17.) Angelini P, Velasco JA, Flamm S. Coronary anomalies: incidence, pathophysiology, and clinical relevance. Circulation. 2002 May;105(20):2449-54.
(18.) Shriki JE, Talkin B, DeFrance T, Wilcox A. Classic images: coronary computed tomographic angiography. Curr Probl Cardiol. 2010 Dec;35(12):599-632. DOI 10.1016/j.cpcardiol.2010.09.004.
(19.) Angelini P, Walmsley RP, Libreros A, Ott DA. Symptomatic anomalous origination of the left coronary artery from the opposite sinus of valsalva. Clinical presentations, diagnosis, and surgical repair. Tex Heart Inst J. 2006;33(2):171-9.
(20.) Krittayaphong R, Maneesai A, Saiviroonporn P, Nakyen S, hanapiboonpol P, Yindeengam A. Prevalence and characters of anomalous coronary artery from coronary magnetic resonance angiography. J Med Assoc Thai. 2014 Mar;97 Suppl 3:S124-31.
(21.) Angelini P, Flamm SD. Newer concepts for imaging anomalous aortic origin of the coronary arteries in adults. Catheter Cardiovasc Interv. 2007 Jun;69(7):942-54.
(22.) Basso C, Maron BJ, Corrado D, Thiene G. Clinical profile of congenital coronary artery anomalies with origin from the wrong aortic sinus leading to sudden death in young competitive athletes. J Am Coll Cardiol. 2000 May;35(6):1493-501.
(23.) Pelliccia A. Congenital coronary artery anomalies in young patients: new perspectives for timely identification. J Am Coll Cardiol. 2001 Feb;37(2):598-600.
(24.) Taylor AJ, Rogan KM, Virmani R. Sudden cardiac death associated with isolated congenital coronary artery anomalies. J Am Coll Cardiol. 1992 Sep;20(3):640-7.
(25.) Angelini P, Velasco JA, Ott D, Khoshnevis GR. Anomalous coronary artery arising from the opposite sinus: descriptive features and pathophysiologic mechanisms, as documented by intravascular ultrasonography. J Invasive Cardiol. 2003 Sep;15(9):507-14.
(26.) Almeida C, Dourado R, Machado C, Santos E, Pelicano N, Pacheco M, et al. [Coronary artery anomalies]. Rev Port Cardiol. 2012 Jul-Aug;31(7-8):477-84. DOI 10.1016/j.repc.2012.05.001. Portuguese.
(27.) Pelliccia A, Spataro A, Maron BJ. Prospective echocardiographic screening for coronary artery anomalies in 1,360 elite competitive athletes. Am J Cardiol. 1993 Oct;72(12):978-9.
(28.) Manghat NE, Morgan-Hughes GJ, Marshall AJ, Roobottom CA. Multidetector row computed tomography: imaging congenital coronary artery anomalies in adults. Heart. 2005 Dec;91(12):1515-22.
(29.) Bunce NH, Lorenz CH, Keegan J, Lesser J, Reyes EM, Firmin DN, et al. Coronary artery anomalies: assessment with free-breathing three-dimensional coronary MR angiography. Radiology. 2003 Apr;227(1):201-8.
(30.) Basso C, Corrado D, Thiene G. Congenital coronary artery anomalies as an important cause of sudden death in the young. Cardiol Rev. 2001 Nov-Dec;9(6):312-7.
(31.) Warnes CA, Williams RG, Bashore TM, Child JS, Connolly HM, Dearani JA, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease). Developed in Collaboration With the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2008 Dec;52(23):e143-263. DOI 10.1016/j.jacc.2008.10.001.
(32.) Angelini P, Uribe C, Monge J, Tobis JM, Elayda MA, Willerson JT. Origin of the right coronary artery from the opposite sinus of Valsalva in adults: Characterization by intravascular ultrasonography at baseline and after stent angioplasty. Catheter Cardiovasc Interv. 2015 Aug;86(2):199-208. DOI 10.1002/ccd.26069.
(33.) Reul RM, Cooley DA, Hallman GL, Reul GJ. Surgical treatment of coronary artery anomalies: report of a 37 1/2-year experience at the Texas Heart Institute. Tex Heart Inst J. 2002;29(4):299-307.
(34.) Krasuski RA, Magyar D, Hart S, Kalahasti V, Lorber R, Hobbs R, et al. Long-term outcome and impact of surgery on adults with coronary arteries originating from the opposite coronary cusp. Circulation. 2011 Jan;123(2):154-62. DOI 10.1161/CIRCULATIONAHA.109.921106.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2015 Iatreia

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Los artículos publicados en la revista están disponibles para ser utilizados bajo la licencia Creative Commons, específicamente son de Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional.
Los trabajos enviados deben ser inéditos y suministrados exclusivamente a la Revista; se exige al autor que envía sus contribuciones presentar los formatos: presentación de artículo y responsabilidad de autoría completamente diligenciados.